永昕開發的生物藥TuNEX於7月12日通過台灣衛生服務部食品藥物管理署(TFDA)查驗登記審核。取得台灣上市藥證後,將有利於拓展海外市場。
TuNEX的適應症是類風濕性關節炎,永昕是TuNEX的原始開發者(product owner) ,遵循國際法規完成了產程開發、臨床前試驗(包含體內及體外有效性試驗、藥品動力學試驗及藥品毒理試驗)及台灣第一/二期人體臨床試驗,這些都是永昕的智慧財產權。2011年與東生華簽約合作開發台灣市場,東生華負責執行第三期臨床試驗及台灣藥品查驗登記,上市後東生華享有台灣獨家銷售權。永昕則掌握藥品的化學製造管控(CMC)的關鍵能力技術,負責TuNEX藥品的製造與供貨。
據台灣風濕病醫學會資料顯示,台灣地區類風溼性關節炎病人數約4-5萬人。而國際生醫統計公司IMS Data資料顯示,台灣地區市場規模約32億元。據臨床三期實驗主持人林孝義醫師表示,TuNEX在臨床顯示的療效跟抗藥性表現不俗,未來將可以造福萬千類風濕性關節炎病患。
TuNEX是第一個台灣廠商自行開發上市的生物新藥,在台灣的製藥史上重重寫下一筆。除了台灣授權予東生華外,永昕擁有TuNEX全球市場的權利。海外其他區域也依循同樣的模式,尋找適合的夥伴強強合作。其中東南亞已選定跟友華合作,主要看中友華在東協各國經營多年,不論是法規、臨床實驗或是物流、行銷皆累積了相當經驗及實力,而其他地區的授權也緊密進行中。
為了建立類風濕性關節炎生物製劑的完整產品線,永昕也積極推動生物相似藥LusiNEX進度 (原廠生物藥:Actemra®),LusiNEX屬於 IL-6抑制劑與TuNEX的TNF-α抑制劑作用機轉不同,可以滿足無法耐受TNF-α患者的需求,全球市場規模高達19億美元。預計在今年可以向歐盟EMA申請人體臨床試驗審查。
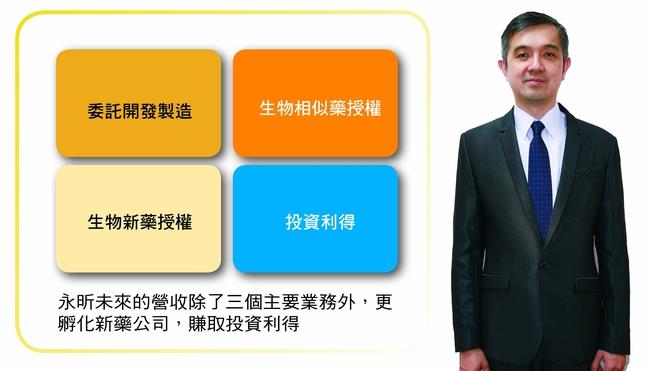
在陳德禮董事長及溫國蘭總經理的領導下,永昕加速運轉,除了TuNEX新藥順利上市外,也積極孵化具潛力的生技公司,利用自身成功經驗及技術,輔導轉投資公司上市櫃以獲得資本利得;並積極與對岸洽談合作,進軍大陸13億人口藥品市場,相信未來能帶領永昕迅速起飛。
圖説: 永昕營收四大面向,右為永昕董事長陳德禮 圖/金融家月刊提供